研究
2022(令和4)年度の大学統合に伴い,大阪公立大学 大学院獣医学研究科 獣医解剖学教室のWEBサイトはこちらに新設しました。2023年以降の情報につきましては,以下のURLよりご確認下さい。
新設サイトURL: https://www.omu.ac.jp/vet/anat/
—————————————————————————————————-
小川教授の研究内容
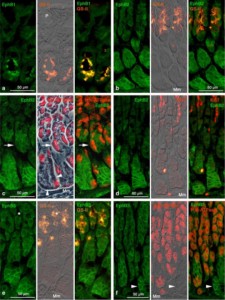
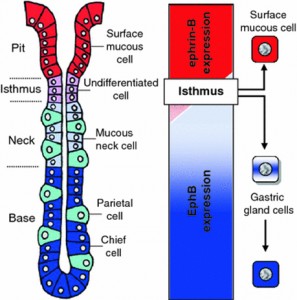
臓器や組織には,それぞれ臓器・組織の顔というべき幾つかの細胞が,特有の細胞構築を形成,これが臓器・組織の機能を営む基盤になっています。この特有の 細胞構築が,それぞれ臓器・組織でどのようにして形づくられ,維持されているのか?研究テーマはこの点に集約できます。ごく最近,培養上で腸上皮独特の腸 陰窩の形成を一個の腸上皮幹細胞から造りあげることに成功した研究が報告されました。複数の分化した細胞が構成要素として加わったこの培養組織は細胞の配 列や分布が本来の腸上皮にと酷似していました。腸上皮幹細胞の遺伝子にプログラムされている神の業なのか?と考えを巡らすときがしばしばです。多細胞生物 の細胞は,様々な分子を使って周囲の細胞と情報伝達を取り,組織化して,個体の生命活動を維持しています。細胞は組織の中で,自己をどのように位置づけて 組織の構成細胞として,あるいは個体の構成細胞として機能しているのか?突き詰めると,細胞間の情報伝達はその重要な因子であると考えています。受容体型 チロシンキナーゼで最大のファミリーを構成するEphとそのリガンドephrinは、発生期の様々な組織に強く発現し、細胞の接着や運動を制御して細胞の 組織形成に働くことが知られている膜タンパクです。成長因子とその受容体の仲間ですが,多くの場合は細胞分裂には働きません。Ephとephrinの特徴 は,細胞が細胞と接触することでシグナルが発生することです。このEphとephrinについて,「細胞が仲間の細胞であるかどうか?(接触を保ち接着す べき細胞であるかどうか?)判断すると分子システムで,発生期に限らす,分化後の成体の臓器・組織でも細胞更新・交替など細胞構築維持や生理的な機能に深 く関与する。」と仮説をたて,これら分子を中心に据えて研究をしています。対象臓器・組織は,胃粘膜,心筋組織,血球と血管内皮,肝臓,腎臓など広範囲に わたり,臓器の再生を成功させるカギになればと研究を進めています。
図:マウスの胃粘膜におけるEphの局在
中島准教授の研究内容
ヒトが心肺停止になった場合、直ちに心肺蘇生法を開始する必要があります。これは単に心臓のポンプ機能を回復させるためだけではなく、脳にいち早く血液を供給する必要があるためです。脳への血液供給が途絶えた状態を脳虚血といいます。心肺停止状態がしばらく続いても心臓はその機能を回復することがあります。しかしながら脳は虚血に対して非常に弱い臓器であるため、心肺停止による脳への血液供給が5分間停止しただけで脳障害が起こります。ラットやスナネズミを用いた実験では脳の中でも特に、海馬が虚血に対して弱いことが知られています。海馬は記憶や認知に重要な脳部位であるため、海馬が障害を受けると認知症や記憶障害になります。現在、脳虚血モデルラットおよび初代培養神経細胞を用いて脳虚血の病態や脳障害軽減のための基礎的研究を行っています。
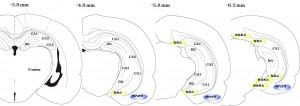
図:5分虚血後の海馬における組織変性
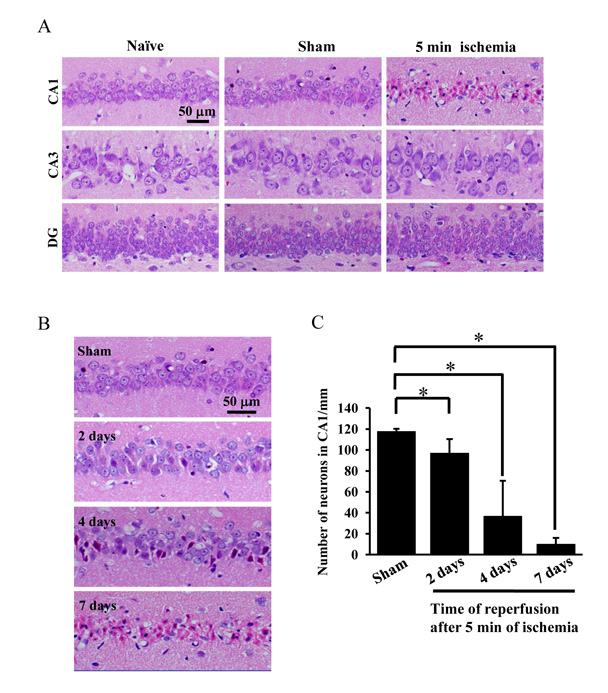 (A) Photographs of hematoxylin/eosin staining sections from naïve, sham-operated rats and rats subjected to 5 min ischemia followed by 7 days of reperfusion. (B) Photographs of hematoxylin/eosin staining sections from sham-operated rats and rats subjected to 5 min ischemia followed by 2 days, 4days and 7 days of reperfusion. (C) The changes in the number of pyramidal neurons per 1-mm length were tested by two-tailed unpaired Student’s t test. Data are expressed as the mean ± standard deviation (SD). *Statistically significant difference from rats subjected to sham-operation (P < 0.05); n = 4. DG dentate gyrus. Sham: sham operation.
(A) Photographs of hematoxylin/eosin staining sections from naïve, sham-operated rats and rats subjected to 5 min ischemia followed by 7 days of reperfusion. (B) Photographs of hematoxylin/eosin staining sections from sham-operated rats and rats subjected to 5 min ischemia followed by 2 days, 4days and 7 days of reperfusion. (C) The changes in the number of pyramidal neurons per 1-mm length were tested by two-tailed unpaired Student’s t test. Data are expressed as the mean ± standard deviation (SD). *Statistically significant difference from rats subjected to sham-operation (P < 0.05); n = 4. DG dentate gyrus. Sham: sham operation.
Transforming growth factor-β (TGF-β) superfamily

谷田講師の研究内容
内分泌・代謝系は生殖,発生,分化や生体恒常性などを司り,核内受容体はその中で中心的な役割を果たしています。核内受容体は,ホルモンを始めとするリガンドに依存した転写制御因子であり,その経路の破綻は様々な疾患,例えば糖尿病,メタボリック・シンドローム,腫瘍,高血圧,鬱などと関わっています。核内受容体はヒトでは大きく48種のグループに分けられ,具体的にはエストロゲン受容体,グルココルチコイド受容体などのステロイドホルモン受容体,甲状腺ホルモン受容体,ビタミンD受容体などが挙げられます。私はこれらの中でも,エストロゲン受容体と相同性は高いもののいかなる生体内リガンドとも結合しない受容体(= オーファン受容体)であるエストロゲン関連受容体(estrogen-related receptor, ERR)に興味を持ち,局在や動態解析を行ってきました。ERRには3つのサブタイプα,β,γが存在しますが,これまで,ERRβがエストロゲン受容体に直接相互作用し,可動性を低下させることでエストロゲン依存的な細胞機能を抑制することや,乳酸応答分子として同定したLRPGC1がERRγを介してミトコンドリアを活性化させ乳酸代謝を促進することなどを明らかにしてきました。現在は,これまで行ってきた研究を基盤に,ERRを含めた核内受容体とこれらを活性化,または抑制する因子の細胞内外の環境,例えば栄養素の寡多,温度,pH,有機酸など各種ストレスに応じた「動き」を可視化し,その機構と意義を追究することで病態解明や治療法開発に貢献することを目指し,基礎研究を行っています。
主に扱う実験手技:
生細胞イメージングや光褪色後蛍光回復法(FRAP)などの細胞内動態解析,遺伝子クローニング,各種PCR,遺伝子ノックダウン,CRISPR/CAS9によるゲノム編集,酵素抗体法・蛍光抗体法による組織細胞染色,ウェスタンブロット,共免疫沈降法や蛍光共鳴エネルギー移動法(FRET)などのタンパク質相互作用解析,レポーター・アッセイ,その他プレートリーダーを用いた各種生化学的解析など。
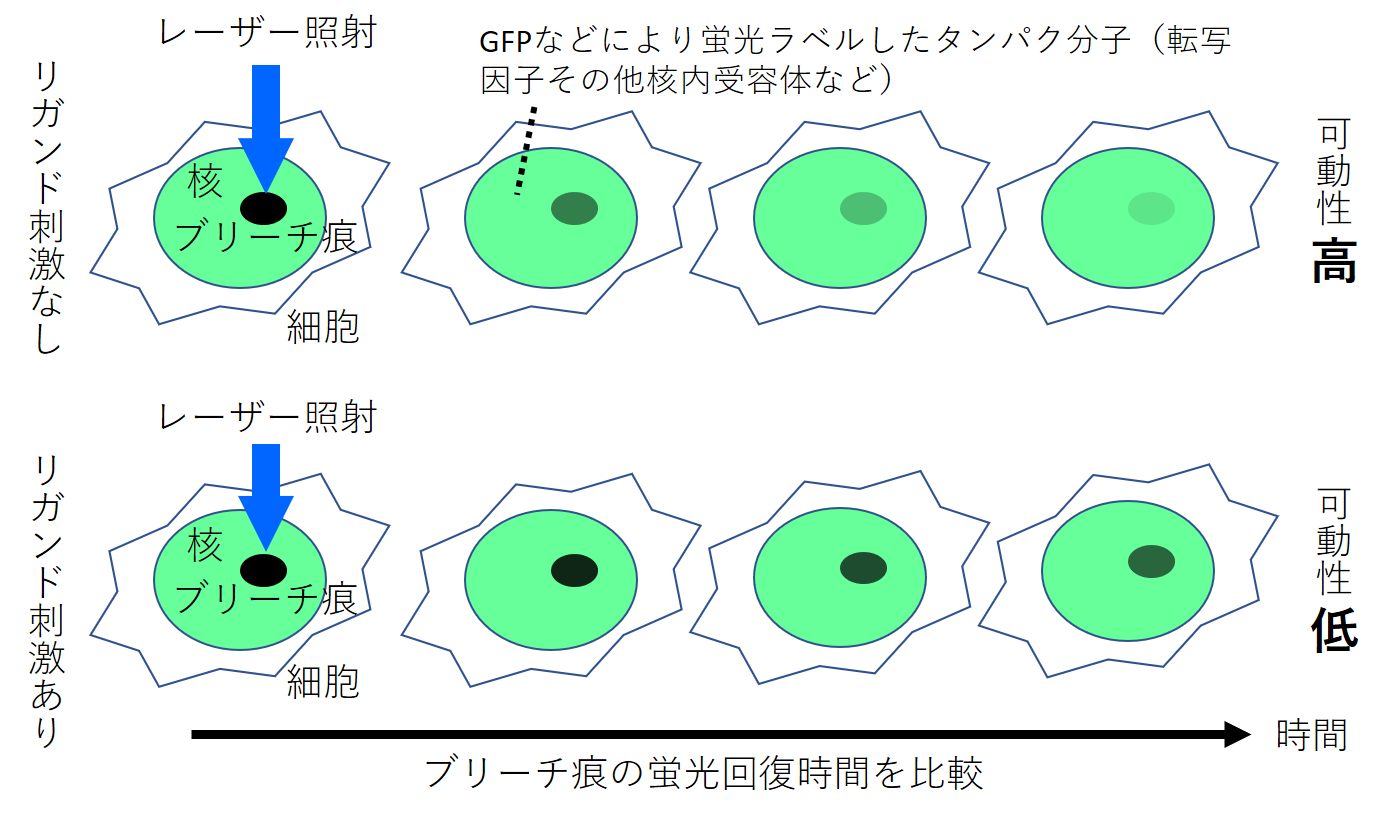
以下の図1,2にFRAPの実験例とその仕組みを示します。この実験は,共焦点レーザー顕微鏡のステージにインキュベーション・チャンバーを設置し,蛍光ラベル付きの目的タンパクを発現させた細胞を生かした状態で行います。
図1.光褪色後蛍光回復法(Fluorescence Recovery After Photobleaching; FRAP)による実験の模式図
FRAPとは,解析したいタンパク分子をGFPなどにより蛍光標識し,レーザー照射による褪色からの蛍光回復時間を計測することで目的タンパク分子の細胞内動態を解析する方法である。蛍光回復時間の延長=可動性の低下=目的タンパク分子が他の分子(転写因子や核内構造体など)と相互作用していることを示す。この実験は,リガンド(ホルモンなど)によって目的タンパク分子が複合体を形成することを示す。
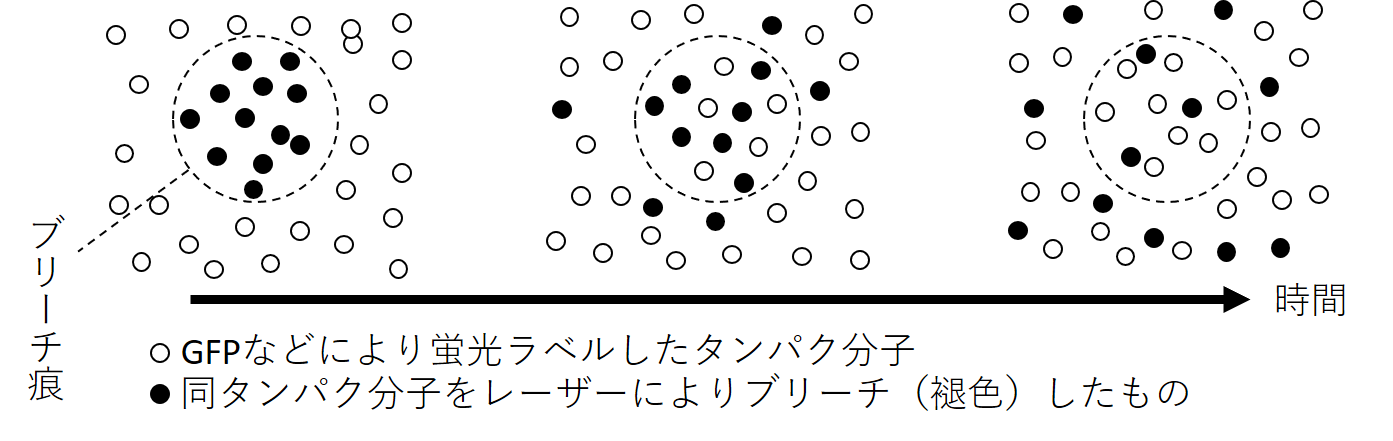
図2.FRAPにおけるブリーチ痕の経時的変化の模式図
細胞内の分子は可動的な状態にあり絶えず動いている。強いレーザー照射により不可逆的に褪色した目的タンパク分子(●)は拡散し,ブリーチ痕(破線)は時間と共に薄まり消えてゆく。目的タンパク分子が他分子と複合体を形成していると,拡散が起こりにくくなり褪色した分子がその場に長時間留まることとなる(=可動性の低下)。
主要参考文献:
Tanida T. Molecular dynamics of estrogen-related receptors and their regulatory proteins: Roles in transcriptional control for endocrine and metabolic signaling. Anat Sci Int. 2022;97:15–29. doi: 10.1007/s12565-021-00634-7
Tanida T, Matsuda KI, Uemura T, Yamaguchi T, Hashimoto T, Kawata M, Tanaka M. Subcellular dynamics of estrogen-related receptors involved in transrepression through interactions with scaffold attachment factor B1. Histochem Cell Biol. 2021 Sep;156(3):239-251. doi: 10.1007/s00418-021-01998-7
Tanida T, Matsuda KI, Tanaka M. Novel metabolic system for lactic acid via LRPGC1/ERRγ signaling pathway. FASEB J. 2020 Oct;34(10):13239-13256. doi: 10.1096/fj.202000492R
Tanida T, Matsuda KI, Yamada S, Kawata M, Tanaka M. Immunohistochemical profiling of estrogen-related receptor gamma in rat brain and colocalization with estrogen receptor alpha in the preoptic area. Brain Res. 2017 Mar 15;1659:71-80. doi: 10.1016/j.brainres.2017.01.024
Tanida T, Matsuda KI, Yamada S, Hashimoto T, Kawata M. Estrogen-related receptor β reduces the subnuclear mobility of estrogen receptor α and suppresses estrogen-dependent cellular function. J Biol Chem. 2015 May 8;290(19):12332-12345. doi: 10.1074/jbc.M114.619098